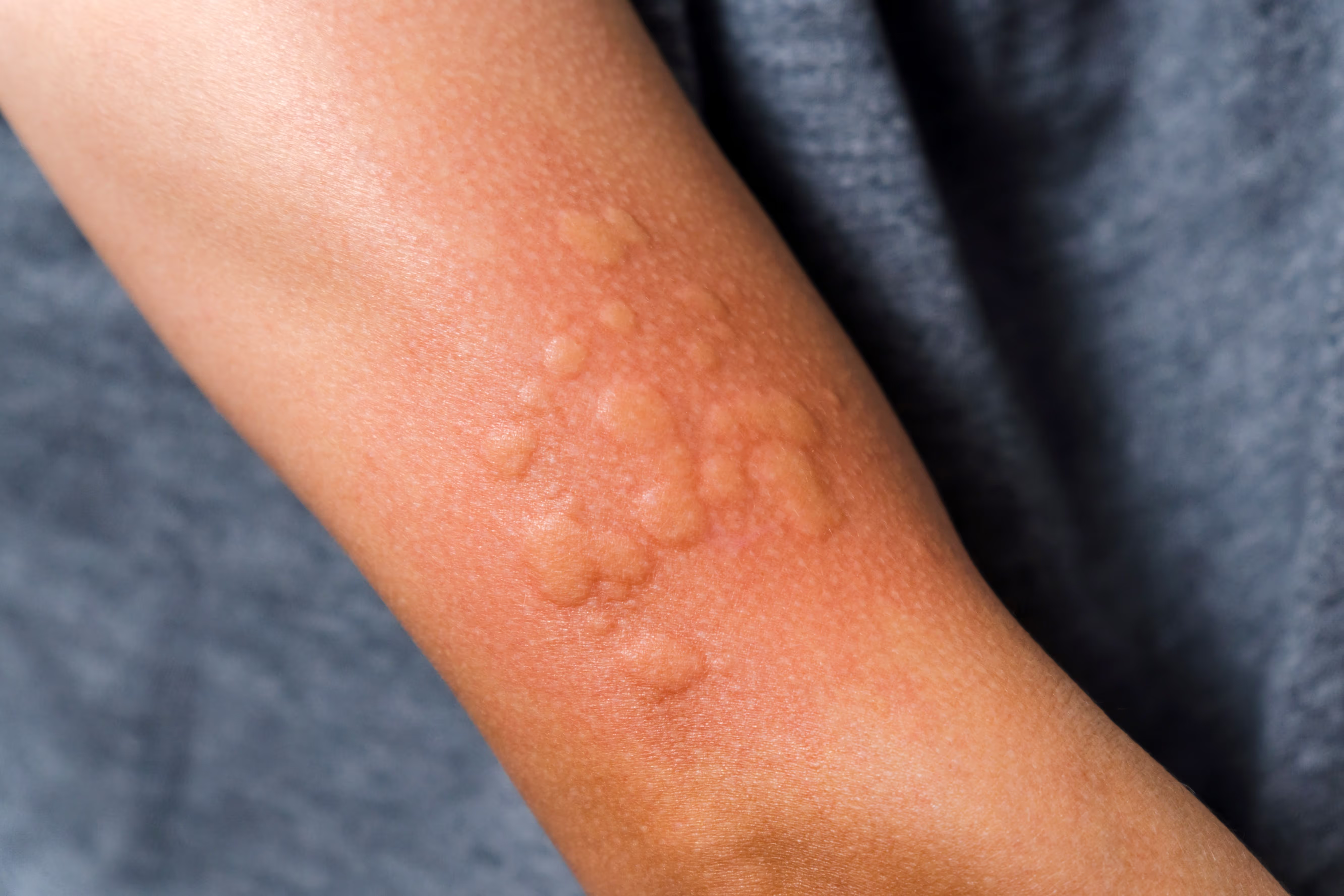
Die Nesselsucht – fachsprachlich Urtikaria – äußert sich durch einen plötzlich auftretenden Hautausschlag in Form von Quaddeln und/oder Schwellungen, die meist stark jucken. Die nicht ansteckende Hauterkrankung ist durch eine Aktivierung bestimmter Entzündungszellen (Mastzellen) gekennzeichnet. Sehr oft gibt es bei Betroffenen keinen erkennbaren Auslöser für die Symptome. In diesem Fall spricht man von einer spontanen Nesselsucht.
Die Beschwerden einer Nesselsucht können körperlich und psychisch sehr belastend sein: Der starke Juckreiz kann die Konzentrationsfähigkeit und den Schlaf beeinträchtigen. Zudem leiden viele Betroffene auch in ästhetischer Hinsicht unter der Erkrankung. Aktuell verfügbare Behandlungsoptionen, darunter Antihistaminika und die Anti-IgE-Therapie mit Omalizumab, schlagen häufig nicht (zufriedenstellend) an.
In dieser Studie werden die Wirksamkeit und Sicherheit eines potenziellen neuen Medikaments untersucht, das noch nirgendwo auf der Welt zugelassen worden ist. Es handelt sich hierbei um einen humanisierten monoklonalen Antikörper. Dieser soll spezifisch die Aktivität der Rezeptor-Tyrosinkinase KIT hemmen und dadurch Mastzellen in der Haut beseitigen. Vorangegangene Studien weisen darauf hin, dass das Prüfmedikament auch bei Nesselsucht-Betroffenen wirksam sein könnte, die auf bisherige Therapiemöglichkeiten nicht (ausreichend) ansprechen.

Sie können wahrscheinlich an der Studie teilnehmen, wenn …
- Sie mindestens 18 Jahre alt sind,
- Sie vor mindestens sechs Monaten die Diagnose einer chronischen spontanen Nesselsucht erhalten haben,
- Sie seit mindestens vier Wochen eine Behandlung mit einem Antihistaminikum der zweiten Generation in stabiler Dosis erhalten,
- Sie trotz der Antihistaminika-Behandlung aktuell und seit mindestens sechs Wochen mittelschwere bis schwere Nesselsucht
-Beschwerden haben (juckende Quaddeln auf der Haut mit oder ohne Schwellungen der Unterhaut) und
- Sie bereit sind, während der Teilnahme hochwirksam zu verhüten (Dies gilt für gebärfähige Frauen und Männer mit gebärfähiger Partnerin; männliche Teilnehmer mit weiblichen gebärfähigen Partnerinnen müssen sich bereit erklären, entweder ein Kondom (mit oder ohne Spermizid) zu verwenden, und ihre weiblichen gebärfähigen Partnerinnen sollten hochwirksame Verhütungsmittel in Betracht ziehen.).
Sie können wahrscheinlich nicht an der Studie teilnehmen, wenn …
- Ihre Nesselsucht-Beschwerden eine bekannte Ursache haben, die die Bewertung der Nesselsucht erschweren kann (z. B. Nahrungsmittelunverträglichkeit, mechanische Reize, Medikamente),
- Sie eine andere Hauterkrankung haben, die Juckreiz auslöst (z. B. Neurodermitis, Schuppenflechte),
- Sie in den letzten drei Monaten eine Anti-IgE-Therapie mit Omalizumab erhalten haben,
- Ihre Vorgeschichte einen anaphylaktischen Schock (schwere allergische Reaktion) oder Herz-Kreislauf-Ereignisse (z. B. Schlaganfall, Herzinfarkt) beinhaltet,
- Sie aus medizinischen Gründen keinen Epinephrin-Autoinjektor (EpiPen) anwenden sollten, oder
- Sie derzeit schwanger oder stillend sind.
- In einem unverbindlichen Beratungsgespräch besprechen wir Ihre Beschwerden und Diagnose.
- Sie bekommen daraufhin genug Bedenkzeit, um sich mit Ihrer Familie oder Ihren Ärzt*innen zu besprechen und sich für oder gegen die Studienteilnahme zu entscheiden.
- Die Teilnahme dauert insgesamt bis zu eineinhalb Jahre und beinhaltet mindestens 19 Visiten vor Ort im Studienzentrum über einen Zeitraum von etwa 15 Monaten. Unser kompetentes und herzliches Team freut sich darauf, Sie langfristig und engmaschig zu betreuen.
- Die Studie ist teilweise Placebo-kontrolliert: Je nach Gruppenzuteilung erhalten Sie entweder das zu untersuchende Prüfmedikament oder ein Placebo (Scheinmedikament). Während der Teilnahme führen Sie Ihre bestehende Antihistaminika-Behandlung fort. Falls Sie während der Placebo-kontrollierten Phase ein Placebo erhalten, werden Sie nach 24 Wochen der aktiven Behandlung zugewiesen.
- Im Rahmen Ihrer Teilnahme müssen Sie ein digitales Tagebuch führen, in dem Sie Ihre Nesselsucht
-Symptome und Ihre Medikamenteneinnahme dokumentieren.
- Den genauen Ablauf der Studie bespricht Ihr*e Studienärzt*in vor der Teilnahme mit Ihnen.
- Sie können Ihre Teilnahme zu jedem Zeitpunkt ohne Angabe von Gründen abbrechen.
Durch Ihre Teilnahme an dieser Studie entstehen für Sie keine zusätzlichen Kosten. Sie erhalten für Ihre Teilnahme keine Bezahlung. Sie erhalten eine Aufwandsentschädigung/Erstattungen der mit den studienbezogenen Visiten verbundenen Kosten oder Sie nutzen für Reisevorkehrungen Scout Clinical, eine vom Studiensponsor beauftragte Organisation.
Die mit den studienbezogenen Visiten möglicherweise verbundenen Kosten (z. B. Kilometergeld, Parkgebühren, Verpflegung bei längeren Visiten) werden Ihnen von Scout Clinical nach Erhalt einer Rechnung oder entsprechender Belege erstattet. Die Zahlung an Sieerfolgt per ScoutPass, PayPal oder Banküberweisung.
Zusätzlich zur Erstattung der Kosten haben Sie Anspruch auf das folgende Stipendium:
- Stipendium für das digitale Tagebuch: Sie erhalten eine Kostenpauschale von ca. 23 Euro für jede im Rahmen der Studie abgeschlossene Visite, bei der Sie das digitale Tagebuch zu mindestens 80 % ausgefüllt haben.
Wir beraten Sie gerne unverbindlich und beantworten all Ihre Fragen. Kontaktieren Sie uns einfach telefonisch unter der (030) 439 741 610 oder melden Sie sich über das Kontaktformular auf dieser Webseite an. Wir freuen uns auf Sie!
Eine Studienteilnahme ist immer mit einem gewissen Aufwand und bestimmten Risiken verbunden. Oft werden Studien beispielsweise placebo-kontrolliert durchgeführt: Daher kann es passieren, dass Sie bei der Teilnahme lediglich ein Scheinmedikament ohne medizinische Wirkstoffe erhalten.
Außerdem kann es zum einen passieren, dass Sie keine Linderung Ihrer Beschwerden erfahren. Zum anderen können bisher unbekannte Nebenwirkungen auftreten. Diesen können wir jedoch mithilfe regelmäßiger Untersuchungen frühzeitig entgegen wirken.
Weitere Informationen zu möglichen Risiken einer Studienteilnahme finden Sie hier.
Eine Studienteilnahme bei uns ist oft mit bestimmten Vorteilen für Sie verbunden. Sie werden zum einen intensiv medizinisch betreut: Wir überprüfen regelmäßig Ihren Gesundheitszustand, nehmen uns viel Zeit für Ihre Belange und unsere Behandlungsmethoden sind von höchster Qualität. Zum anderen erhalten Sie eventuell ein neues Medikament und somit die Chance, Ihre Beschwerden zu lindern und Ihren Gesundheitszustand zu verbessern.
Zudem leisten Sie einen wichtigen Beitrag zur Entwicklung wirksamer und sicherer Medikamente, die sowohl Ihnen selbst als auch Ihren Mitmenschen und kommenden Generationen helfen können. Zu guter Letzt ist Ihre Studienteilnahme bei uns kosten- und zuzahlungsfrei. Ihren Aufwand möchten wir selbstverständlich angemessen erstatten: Je nach Studie erhalten unsere Patient*innen Fahrtkostenpauschalen oder wir erstatten das Kilometergeld.
Weitere Informationen zu möglichen Risiken einer Studienteilnahme finden Sie hier.
Ein Placebo ist ein so genanntes „Schein-Medikament“. Es sieht genauso aus wie die wirksame Medikation, besteht jedoch nur aus Zucker oder ähnlichen Stoffen. Placebos kommen in den meisten Studien zum Einsatz, wenn man sicher unterscheiden möchte, welche Wirkungen auf das neue Medikament und welche auf andere Faktoren wie Spontanheilungen, psychotherapeutische Wirkungen oder anderes zurückzuführen sind.
Weder der/die Studienteilnehmer*in noch das Studienteam weiß, ob dem/der Teilnehmenden bei Placebo-kontrollierten Studien der Wirkstoff oder ein Scheinmedikament verabreicht wird. Nach dem Ende der Studie wird diese Information im Rahmen der sogenannten "Entblindung" bekanntgegeben.
Der größte Teil unserer Studien wird ambulant durchgeführt, das heißt, dass Sie zu regelmäßigen Untersuchungsterminen ohne Übernachtung zu uns kommen. Eine Ausnahme hiervon sind die Schlaflaborstudien, bei denen Übernachtungen beinhaltet sind.
Die Anmeldung zur Teilnahme ist einfach! Wenn Sie sich für eine bestimmte Studie interessieren, melden Sie sich am besten über das Kontaktformular auf der jeweiligen Studienseite an.
Gesunde Studienteilnehmer*innen, die sich zur Überprüfung der Verträglichkeit neuer Medikamente in so genannten Phase-I-Studien zur Verfügung stellen, erhalten für das Risiko, das sie eingehen, relativ hohe Summen als Entschädigung. Wir führen jedoch überwiegend Studien der Phasen II-IV durch, in denen die Wirksamkeit der Medikamente getestet wird. Hier dürfen aus ethischen Gründen keine hohen Summen an Studienteilnehmer*innen ausgezahlt werden. Die konkreten Summen unterscheiden sich jedoch von Studie zu Studie, bitte erfragen Sie diese direkt bei uns.
Ein Datenschutzbeauftragter stellt sicher, dass alle nationalen und internationalen Datenschutzgesetze konsequent eingehalten werden. Es werden ausschließlich anonymisierte Krankheitsdaten verwendet, die für die Bewertung von Medikamentenwirkungen erforderlich sind. Persönliche Daten wie Name oder Adresse werden nicht weitergegeben – weder an Auftraggeberinnen, Werbefirmen noch andere Interessentinnen. Zudem sind alle Mitarbeitenden zur Verschwiegenheit verpflichtet und unterliegen dem Arztgeheimnis.
Es bedeutet, Teil eines wichtigen wissenschaftlichen Prozesses zu werden, der darauf abzielt, neue Behandlungsmöglichkeiten und medizinische Erkenntnisse zu gewinnen. Als Proband*in durchlaufen Sie einen gut strukturierten und betreuten Prozess. Dieser beinhaltet folgende Schritte:
- Bevor die Studie beginnt, erhalten Sie ausführliche Informationen über den Zweck, den Ablauf und die möglichen Risiken und Vorteile der Studie.
- Sie geben eine informierte Einwilligung, die sicherstellt, dass Sie alle Aspekte der Studie verstehen und freiwillig teilnehmen.
- Während der gesamten Studiendauer werden Sie von erfahrenem medizinischem Personal betreut.
- Es gibt regelmäßige Untersuchungen und Überprüfungen, um Ihre Gesundheit und Ihr Wohlbefinden sicherzustellen.
Das unterscheidet sich von Studie zu Studie und hängt von der Phase ab. Studien der Phasen II und III werden mit noch nicht zugelassenen Medikamenten durchgeführt, Studien der Phase IV untersuchen spezielle Fragestellungen mit bereits zugelassenen Medikamenten. Teilweise führen wir auch Studien durch, deren Medikamente in Europa noch nicht zugelassen sind, in anderen Ländern aber bereits in den Apotheken zur Verfügung stehen.
Viele andere häufige Fragen und Antworten haben wir hier für Sie zusammengefasst. Ihr Anliegen ist nicht dabei? Zögern Sie nicht, uns zu kontaktieren!